En los últimos
100 años el estudio de los seres vivos se ha colocado a la vanguardia
de la ciencia. El Proyecto Genoma Humano es hoy su parte más visible,
por los alcances que involucra y el gran debate que moviliza.
Natt Ridley, en su
obra Genoma: la autobiografía de una especie en 23 capítulos
afirma: “Algunos pueden declarar que el ser humano es
algo más que sus genes. No lo niego. Hay mucho más en cada
uno de nosotros que un código genético. Pero hasta ahora
los genes humanos eran casi un completo misterio. Nosotros seremos la primera
generación en penetrar ese misterio. Estamos en la antesala de nuevas
y grandes respuestas, pero, aún más, de nuevas y grandes
preguntas”.
Nuestros cuerpos y el de
todos los organismos vivos están formados por células. Éstas
producen la mayor parte de las sustancias que necesitan los organismos
para vivir. De ellas, las proteínas, cumplen múltiples funciones
dentro de los organismos. Pero las células necesitan instrucciones
para fabricar las proteínas necesarias. Estas instrucciones son
impartidas por los ”genes”. Los genes son como frases escritas en un lenguaje
químico y alineadas en una cadena llamada ADN (ácido desoxirribonucleico),
por eso decimos que en todo organismo vivo, la molécula de ADN constituye
un auténtico archivo genético. Los cálculos que manejan
los investigadores sugieren que la información genética del
hombre equivaldría a una biblioteca de 1000 volúmenes, con
100 páginas cada uno y 3000 letras cada página. Toda esta
información, organizada en al menos 100.000 genes repartidos en
los diferentes cromosomas (22 pares más los cromosomas X e Y que
determina el sexo), es lo que se denomina genoma.
De este gigantesco código
dependen no sólo las características que nos diferencian
de las demás especies, sino también las que nos hacen únicos
e irrepetibles. El problema es cómo sacar a la luz el contenido
de esta gran cantidad de información, o lo que es lo mismo, cómo
transcribir paso a paso este extenso lenguaje bioquímico. El alfabeto
en el que están escritas las órdenes genéticas consta
únicamente de cuatro bases bioquímicas denominadas nucleótidos,
y que se designan por las cuatro letras de sus iniciales A (adenina), C
(citosina), T (timina) y G (guanina). Todo el lenguaje de la vida es la
combinación de enlaces A-T y C-G. Ahora bien, estamos hablando en
el caso del hombre, de un texto escrito en 3.000 millones de pares de bases.
Descifrar este texto es lo que se denomina secuenciar el genoma humano.
En su interés por
descifrar los secretos del ADN, los genetistas y las empresas de biotecnología,
bajo el auspicio del National Institutes of Health (Instituto de Salud
Pública de EE.UU.) y el Departamento de Energía, han venido
desarrollando un proyecto que, por su alcance y costo (3.000 millones de
dólares en quince años), se ha comparado con el proyecto
espacial de los Estados Unidos. Bajo el nombre de Proyecto Genoma Humano
(HGP, en ingles), se intentó construir un mapa de todas las secuencias
del ADN de un prototipo humano. Los objetivos y metas inicialmente plantadas
en este proyecto fueron:
- Identificar cada uno
de los aproximadamente 100.000 genes presentes en el ADN humano.
- Determinar la secuencia
de 3.000 millones de bases químicas que componen el ADN humano.
- Almacenar la información
en bases de datos.
- Desarrollar herramientas
para el análisis de datos.
- Transferir las tecnologías
relacionadas al sector privado.
- Discutir los alcances
éticos, legales y sociales de estos descubrimientos.
El proyecto comenzó
al final de la década del ochenta. Durante un largo período
se avanzó poco, pero en los últimos años, los rápidos
avances tecnológicos aceleraron su culminación. El 26 de
junio de 2000, se presentó un “borrador aproximado”
del código genético del ser humano, y hoy, éste se
puede leer en Internet (www.ncbi.nlm.nih.gov)
Desde el redescubrimiento
de las leyes Gregord Mendel, a la secuenciación del ADN humano
presentada en junio del año pasado, por los grupos de Francis Collins
y Craig Venter, ha pasado un siglo. Hoy nos encontramos frente al primer
borrador de la secuenciación, incompleta por definición,
de nuestra dotación genética y nos espera un largo camino
para alcanzar a entender la misión que cumplen los genes.
Este proyecto ha suscitado
análisis éticos, legales, sociales y humanos que han ido
más allá de la investigación científica
propiamente dicha. A nivel internacional la Organización Cultural,
Científica y Educativa de las Naciones Unidas (UNESCO) ha redactado
la “Declaración para la Protección del Genoma Humano” proponiendo
un número de regulaciones dirigidas a proteger la libertad de investigación
mientras no se atente contra los principios básicos de la dignidad
humana universalmente aceptados. (Ver recuadro).
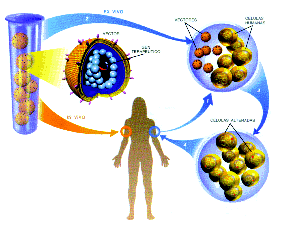
Figura 1. La introducción de genes en humanos se puede llevar a cabo dirigiendo directamente (flecha naranja) los vectores (agentes que portan los genes con capacidad terapéutica) hacia los tejidos deseados (in vivo). Existe otra estrategia llamada ex vivo (flechas azules). En ella, los médicos extraen las células de un paciente, les agregan en el laboratorio el gen deseado y las vuelven a introducir en el paciente una vez corregidas genéticamente. Una de las estrategias in vivo actualmente en estudio, se basa en la utilización de vectores idóneos, que se inyecten en el torrente sanguíneo o en otra parte y se dirijan hacia tipos celulares específicos de cualquier parte del cuerpo. |
Figura 2.
|
MEDICINAS A BASE DE GENES
En medicina se han producido
cambios revolucionarios en los últimos siglos como la introducción
de la microscopia, anestesia, vacunación, antibióticos hasta
el desarrollo de las técnicas de transplantes. La medicina ahora
se prepara para entrar en una era en donde se emplearán de forma
rutinaria los genes en la curación o alivio de enfermedades de todo
tipo, heredadas o adquiridas.
Es probable que en un futuro
inmediato los problemas de salud se aborden con técnicas genéticas.
Las enfermedades hereditarias, el cáncer y las patologías
vasculares son algunos de los ambiciosos objetivos de la terapia génica.
Recordemos que un gen de una célula humana es un segmento de ADN
que, en la mayoría de los casos, contiene la información
para fabricar una proteína específica. Todas las células
del cuerpo poseen los mismos genes en los cromosomas que están en
el núcleo. Pero las células nerviosas, por ejemplo, no se
comportan igual que las células hepáticas. Células
distintas utilizan, o expresan, subgrupos diferentes de genes y , por lo
tanto, fabrican distintos grupos de proteínas. Si un gen particular
muta, su producto proteínico puede no fabricarse, funcionar poco
o hacerlo de forma agresiva. En cualquier caso, el defecto puede alterar
funciones vitales de las células y tejidos que utilizan el producto
génico normal y , en consecuencia, originar alguna enfermedad.
La terapia génica
representa una estrategia novedosa y la diferencia fundamental con todas
las terapias empleadas hasta el momento, es la utilización de un
gen como agente terapéutico. El conocimiento obtenido a partir de
la secuenciación del genoma humano impulsará el desarrollo
de este nuevo campo de la medicina.
Se conocen más de
5.000 enfermedades genéticas diferentes, que se originan por la
alteración de un único gen. Ejemplos de éstas son
la inmunodeficiencia congénita, que priva al organismo de sus defensas
inmunológicas y transforma una infección banal en una amenaza
mortal, la fibrosis quística, que daña progresivamente las
vías respiratorias y el páncreas, la distrofia muscular y
la hipercolesterolemia familiar que determina la aparición temprana
de aterosclerosis grave. En general las enfermedades genéticas son
complejas y afectan múltiples sistemas. Si bien se han realizado
muchos avances en el conocimiento de los mecanismos patológicos
y en el diagnóstico de estas enfermedades, no ha ocurrido lo mismo
en el área del tratamiento. Solamente se pueden tratar los síntomas
de este tipo de enfermedades, no existiendo forma de curarlas de raíz.
Como resultado de otras investigaciones, hoy sabemos también, que
las enfermedades adquiridas a menudo presentan un componente genético
predisponente.
La terapia génica,
experimentada por primera vez en los Estados Unidos, en 1990, es un conjunto
de técnicas que tiene como objetivo reemplazar los genes de ADN
defectuosos de los enfermos, y así resolver el problema desde su
causa. Más de la mitad de los ensayos clínicos de terapia
génica que se están llevando a cabo en la actualidad, están
relacionados al cáncer, que en la mayoría de los casos no
es hereditario, sino que se producen como consecuencia de mutaciones adquiridas
producidas por factores externos (el humo del tabaco, las radiaciones a
altas dosis, etc.). Otros ensayos se centran en el tratamiento de patologías
cardiovasculares y en el Sida.
Para el tratamiento de las
enfermedades hereditarias como la inmunodeficiencia congénita o
la fibrosis quística, la estrategia consiste en introducir
el gen sano en un tipo celular seleccionado, para compensar la falta o
el mal funcionamiento del gen alterado.
Distinta es la estrategia
utilizada por la terapia génica para el tratamiento de diferentes
tipos de cáncer para los cuales se trata de que las células
cancerosas fabriquen sustancias que sean tóxicas para ellas mismas,
provoquen una respuesta enérgica del sistema inmune o corten el
suministro de sangre que los tumores necesitan para seguir desarrollándose.
Cuando comenzaron las investigaciones
sobre terapia génica, pocos predijeron que el corazón sería
uno de los grandes beneficiarios de sus descubrimientos. Se suponía
que serían útiles en enfermedades hereditarias, pero no para
prevenir patologías coronarias, la enfermedad más corriente
del mundo. El tratamiento de los males cardiovasculares es la última
frontera de la terapia génica. Intervienen muchos factores en su
aparición: puede depender de una predisposición hereditaria
tanto como de causas externas, como el estilo de vida y la alimentación.
En este caso la terapia génica no apunta a la corrección
del ADN defectuoso, sino que intenta estimular el crecimiento de nuevos
vasos sanguíneos (proceso llamado angiogénesis) para aligerar
la carga de los vasos dañados. De esta forma se intenta restablecer
el abastecimiento del oxígeno necesario para que sobrevivan los
tejidos.
La inserción de genes
en células cerebrales puede brindar la posibilidad de revertir también
lesiones producidas por enfermedades neurodegenerativas. En los últimos
años, se ha avanzado en el conocimiento de la muerte de las neuronas
provocada por una lesión súbita (accidente cerebrovascular),
por convulsiones o por enfermedades de carácter progresivo como
la enfermedad de Parkinson o la de Alzheimer. El éxito obtenido
en animales de laboratorio fomenta la esperanza de que acabarán
por surgir nuevos tratamientos para estas enfermedades en donde la terapia
génica podrá ocupar un papel importante.
La idea de utilizar genes
para tratar enfermedades desde el punto de vista teórico es una
realidad, pero para su aplicación generalizada queda mucho camino
por recorrer. Algunos miembros de la comunidad científica y de empresas
de biotecnología han puesto demasiadas expectativas, dejando de
lado las dificultades que presenta su aplicación concreta. Es por
eso que, entre la idea y su realización hay varios obstáculos
por superar. Uno de ellos es encontrar un vehículo o “chofer” inocuo
y eficaz para transportar los genes correctores. Los investigadores apuestan
por un virus. Los manipulan en el laboratorio, para hacerlos inofensivos
e injertar en su interior el gen sano. Aprovechan así su capacidad
natural para introducirse en las células y volcar en el núcleo
su propio material genético. Los virus más empleados son
los retrovirus y los adenovirus. También se han hecho pruebas con
liposomas, pequeñas perlas de grasas en las que se coloca un segmento
de ADN que contenga los genes terapéuticos o con la inyección
directa del ADN desnudo, es decir sin la envoltura lipídica.
Existen otros problemas
asociados a la utilización de la terapia génica: el rechazo
y la permanencia del ADN instalado. El sistema inmunológico
del paciente ataca a los virus portadores del gen sano y mata a gran parte
de ellos antes de que puedan llegar a su objetivo, las células
“diana”. A veces también ellas rechazan el gen extraño y
lo neutralizan. Es necesario encontrar un “truco” que permita engañar
estas defensas naturales. Cuando se logre, los efectos del tratamiento
serán duraderos y no habrá necesidad de repetirlo periódicamente.
En la actualidad no cabe
duda que los avances propiciados por el Proyecto Genoma Humano, así
como el mejor conocimiento de las bases moleculares de las patologías
y los estudios experimentales que se están llevando a cabo en terapia
génica, permitirán en un futuro próximo que la utilización
de genes como fármacos o medicamentos sea una realidad con insospechadas
aplicaciones terapéuticas.
(*) Dra. Cristina Bogni,
MSc. Valeria Primo, Dra. Claudia Raspanti, Mic. Elina Reinoso.
Fac. de Cs. Exactas,
Físico-Químicas y Naturales. Dpto. de Microbiología
e Inmuniología. UNRC. Orientación: Genética Microbiana.
E-mail: cbogni@exa.unrc.edu.ar
P a r a p e n s a r s o b r e e l g e n o m a *
Sin lugar a dudas el secuenciamiento de los
3.000 millones de pares de bases que constituyen el genoma humano ha significado
un hito muy importante en el avance del conocimiento. Para su logro,
alcanzado antes de lo previsto inicialmente, se revolucionaron los métodos
de secuencia-miento automático y los programas de bioinfor-mática
capaces de procesar la enorme cantidad de datos emergentes. Paralelamente
al desarrollo del proyecto genoma humano y gracias a los avances técnicos
concomitantes, se secuenciaron los genomas de decenas de bacterias, de
la levadura, de un gusano (Caenorhabditis elegans), de la mosquita de la
fruta (Drosophila melanogaster), de la planta Arabidopsis thaliana, y está
en vías de realización el secuen-ciamiento del genoma del
ratón (Mus musculus).
Múltiples son las derivaciones de
estos avances y varias las sorpresas. Aparentemente el enorme genoma
humano
contendría aproximadamente 30.000 a 40.000 genes que codifican proteínas.
Este número es sólo poco mayor que los 15.000 ó 20.000
genes llevados por la mosquita de la fruta o el gusano C. elegans y
¡sólo 5 veces mayor que los genes de una levadura! Craig
Venter, director de uno de los grupos que lograron completar el secuen-ciamiento
del genoma humano, ha expresado que la clásica visión reduccionista
resultaría inadecuada para interpretar la función de todos
los genes y propone que las complejas redes gené-ticas deben ser
estudiadas bajo nuevos enfoques teóricos de acuerdo con la premisa
que fenómenos no-deterministas o caóticos puedan controlar
el funcionamiento del genoma humano.
Otras derivaciones dentro del ámbito
de la biología involucran la posibilidad de una mejor interpretación
de la evolución biológica. Así se podrá
en algún momento comparar nuestro genoma con el de nuestro pariente
más cercano, el chimpancé, del cual diferimos en sólo
¡un 1%!. Podremos también comprender mejor, entre otros,
los intrincados mecanismos del desarrollo embrionario, la diferenciación
celular y el envejecimiento celular.
Ello redundará, como se ha sido señalado
en los medios de comunicación masiva, en importantes avances en
el área médica y la salud humana.
Se agregan a todo esto las enormes implicancias
legales, éticas y sociales que derivan del secuenciamiento del genoma
humano.
Así, ya se plantean grandes problemas
a nivel del patentamiento de algunas secuencias génicas por las
grandes compañías farmacéuticas y biotecnológicas
en previsión de las potenciales ganancias que puedan derivarse de
los nuevos conocimientos y de los productos derivados.
Otro de los muchos nuevos problemas consiste
en establecer el grado de privacidad con que se debe manejar la información
genética de un individuo. Se estima que cada persona portará
en el futuro su carnet de identificación biológica, una tarjeta
portadora de SNPs (indicadores de polimorfismos en las secuencias del ADN).
Esa información permitiría predecir la probabilidad de la
manifestación de una enfermedad genética.
¿Que sucedería frente a la predisposición a enfermedades
de distinto grado de gravedad cuya prevención o cura se desconoce?
¿Cómo se deberá manejar la información derivada
frente al paciente y con familiares, que también pueden ser portadores
de esta anomalía?. Por otro lado, ese conocimiento bien podría
ser empleado por empresas de seguro ó de salud para excluir a aquellas
personas que mostraran en su genoma la predisposición a adquirir
una determinada enfermedad, más o menos invalidante. Es necesario
que las personas puedan acceder a un adecuado conocimiento de las distintas
situaciones para que como individuos o sociedades puedan tomar las decisiones
correctas y cuenten con un marco legal adecuado que los proteja frente
a los abusos.
(*) por Dra. Rosa Nagel
Investigadora principal de CONICET.
E-mail: Ronagel@mail.retina.ar